最近,软凝聚态物理及交叉研究中心丁泓铭副教授(并列第一作者)、马余强教授(共同通讯作者)与上海交通大学医学院分子医学研究院左小磊研究员合作,在DNA材料捕获循环肿瘤细胞方面取得重要进展,相关工作以“DNA framework-programmed cell capture via topology-engineered receptor-ligand interactions”为题发表在美国化学会旗舰期刊[J. Am. Chem. Soc., 141, 18910-18915 (2019)]。
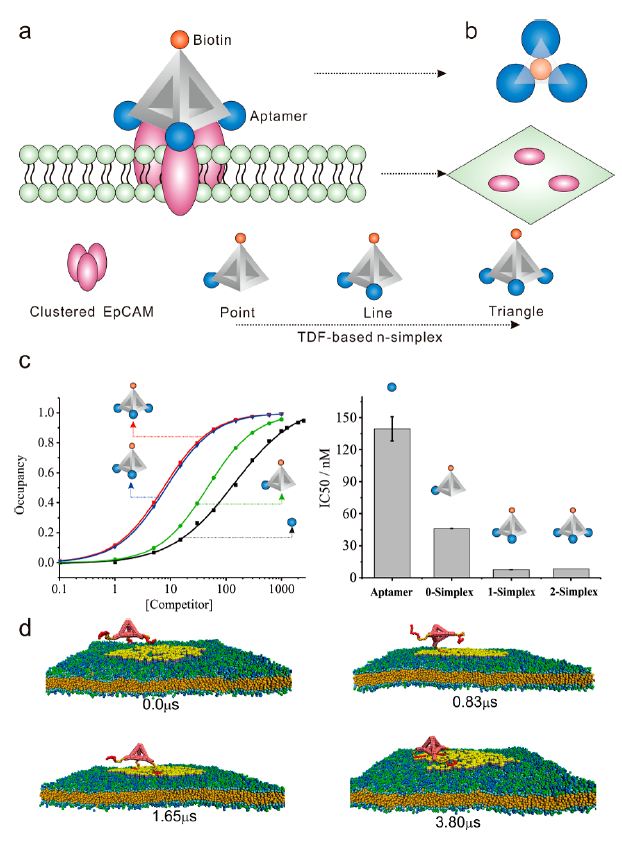
在这项工作中,左小磊课题组采用自组装框架核酸合成了具有特定结构的拓扑适配体,将循环肿瘤细胞的识别模式由单一结合作用提升至拓扑结构诱导的多价结合作用,且该方法具有可编程设计的优点。此外,他们在实验中还发现带有三个适配体的TDF结构(2- simplex)不仅显示出与细胞黏附蛋白(EpCAM)更强的结合亲和力,而且能防止细胞内吞,是最为理想的高效捕获循环肿瘤细胞的DNA材料。为了进一步从微观和介观尺度上理解2-simplex的高吸附能力和低内吞效率, 丁泓铭副教授、马余强教授采用耗散粒子动力学模拟方法构建和刻画了不同TDF结构(0-simplex,1-simplex,2-simplex)与细胞的相互作用过程。他们借鉴化学中的成键思想,在模拟中提出了TDF-EpCAM的单键、双键、三键思想——当它们之间仅形成单键的情况下,尽管TDF能够吸附到细胞膜的EpCAM区域,但是TDF还有比较大的空间自由度(单键能够自由旋转),依然有可能接触到细胞膜上的其他区域从而被细胞内吞;而当它们间形成双键尤其是三键的情况下(双键、三键不能自由旋转),TDF能够牢固地吸附在EpCAM区域,从而极大地降低细胞内吞效率。相关模拟结果很好地解释了实验中的现象。