最近,软凝聚态物理及交叉研究中心的丁泓铭-马余强课题组在在纳米材料表面蛋白冠的调控及生物学效应等方面取得重要进展,最新研究成果以“Tailoring the component of protein corona via simple chemistry”为题发表在Nature Communications 10, 4520 (2019)上。该工作与南京医科大学霍达教授等合作,通过结合理论模拟与实验,提出了一种可以有效操控纳米材料表面蛋白冠成分的简单方法,并从分子、细胞和组织层次揭示了纳米材料表面修饰对其在生物体内代谢影响的内在机理。南京大学-苏州大学联合培养博士生卢翔是论文的第一作者,马余强教授、丁泓铭副教授和南京医科大学霍达教授是论文的共同通讯作者。
当纳米材料进入生物环境中(例如血液),由于其大的比表面积和高的吸附活性,表面会吸附大量的血浆蛋白,形成蛋白冠(protein corona)。这层蛋白质冠的形成不仅会影响蛋白质分子本身的结构和生物功能,同时也会改变纳米材料的生物学行为。因此,如何理解纳米材料与血浆蛋白的作用,特别是精确调控纳米材料表面蛋白冠的组成,对在生物医学领域更好地利用纳米材料乃至未来个性化的医学治疗至关重要。
在这项工作中,作者首先通过全原子分子动力学模拟研究了三种典型血浆蛋白(HSA,IgE, ApoE)与不同表面修饰的石墨烯作用机理。研究发现,随着石墨烯表面羟基数目的增多,HSA与IgE的吸附面积逐渐下降(图1a-b);而ApoE的吸附面积却与石墨烯表面羟基数目无明显关联(图1c)。通过进一步分析蛋白质吸附到石墨烯上的构象,我们发现二级结构的变化是影响蛋白质吸附面积的关键因素——对于具有疏水内核结构的HSA和以beta片为主的IgE而言,随着纳米材料亲水度的增加,二级结构破坏逐渐减弱,从而吸附面积逐渐降低;而对于以alpha结构为主和亲疏水相间的ApoE而言,亲水和疏水表面对其二级结构的破坏无明显差别,从而其吸附面积没有太大区别(图1d)。以上结果也得到了蛋白质体外吸附实验的证实(图1e),即通过调控纳米材料表面亲疏水性可以有效地调控纳米材料的蛋白冠成分。此外,我们还以金纳米材料为例,进一步地证明了我们结果的普适性(图2)。
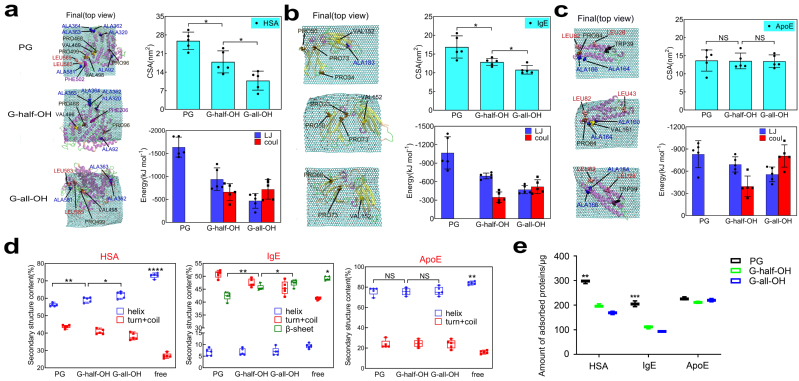
图1. 不同表面修饰石墨烯与三种血浆蛋白相互作用的全原子模拟和体外实验结果。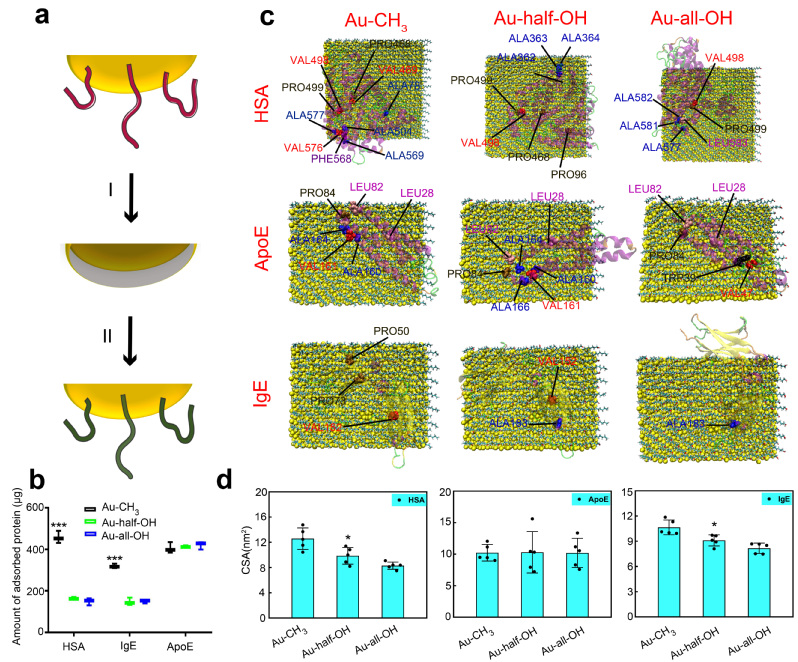
图2. 不同表面修饰金纳米粒子与三种血浆蛋白相互作用的全原子模拟和体外实验结果。
更为有意义地是,HSA和IgE(特别是IgE)的吸附能够提高纳米材料被免疫系统清除的概率,ApoE的吸附则会降低纳米材料被免疫系统识别的可能性;而我们的结果表明,通过简单调控纳米材料表面的亲疏水度,能够显著地降低HSA和IgE在纳米材料表面的吸附行为,而对ApoE的吸附不会造成太大的影响(特别是当羟基在纳米材料表面呈现两面神型分布时,ApoE的吸附面积会进一步提高),从而能够极大地提高纳米材料在血液中的循环时间和达到肿瘤组织的数量。相关的体内实验完全验证了这一想法;此外作者还发现通过预吸附ApoE在纳米材料表面,能够进一步提高纳米材料在肿瘤组织的富集量。


